El pasado 20 de mayo realizamos el evento de forma virtual en la primera jornada de Open Innovation del HUB Salud para esclarecer el desarrollo del proceso al que se enfrentan prácticamente todas las empresas del sector salud: Proceso de obtención del (ansiado) marcado CE de un producto sanitario.
Para esta jornada, contamos con dos ponentes de primer nivel y expertas en el proceso de marcado CE: María Aláez (Directora técnica en FENIN) y Loreto Del Río (Medical Devices Manager, SGS).


Nuestros ya habituales Open Innovation son jornadas online en los que desarrollamos una mesa redonda para transmitir erudición y experiencias desarrolladas por los ponentes donde los asistentes son responsables de innovación de grandes corporaciones. Las jornadas forman parte de la colaboración entre Lanzadera y empresas para fomentar la Innovación abierta.
En esta jornada, desarrollamos junto a María y Loreto las fases para conseguir un marcado CE, así como aclarar las dudas de los asistentes, <<que no fueron pocas>>.
Nos respondieron preguntas como…
¿Cómo saber si mi producto es sanitario? ¿Cuáles son los tiempos de obtención del marcado? ¿Cómo se está produciendo el cambio de normativa?
Cabe destacar, que el principal objetivo de estas jornadas es que los ponentes compartan su conocimiento tratando de inspirar a los asistentes y así, poder generar aprendizaje aportando valor a través de la innovación.

Pero… ¿y qué es un marcado CE?
Se trata de un certificado necesario para los productos sanitarios. Estos productos se evalúan según normativas relevantes y deben cumplir con la regulación en términos de seguridad, salud y requisitos de protección ambiental. El certificado CE se aplica a todos los productos fabricados tanto en países de la Unión Europea como importados a la Unión Europea por lo que se trata de un “pasaporte” para poder venderlo en estos lugares sin ninguna necesidad de un certificado adicional.

¿Y por qué escogimos a estas ponentes?
Porque sus empresas son líderes en el sector sanitario y ellas son unas expertas en el proceso del marcado CE.
SGS es líder mundial en inspección, verificación, análisis y certificación. Está considerada como principal referente mundial en calidad e integridad, contando con más de 89.000 empleados y con una red de más de 2.600 oficinas y laboratorios por todo el mundo.
Loreto Del Río lleva trabajando en certificación de empresas y sistemas en SGS desde 2003. Actualmente dirige el esquema de Certificación de Medical Devices (ISO 13485 y Marcado CE de productos sanitarios) y el área de Knowledge de zona Centro.

Por su parte, Fenin es la Federación Española de Empresas de Tecnología Sanitaria y nació con la misión de agrupar a las empresas españolas de este sector, coordinar y defender sus intereses generales y ostentar su representación ante las autoridades autonómicas, nacionales y europeas.
Cuatro décadas trabajando por la investigación y el desarrollo tecnológico, que permiten poner al alcance de todos tecnologías, productos y servicios que mejoran la prevención, el diagnóstico, el tratamiento y el control y seguimiento de las enfermedades. María Aláez es Doctora farmacéutica y comenzó hace 25 años en Fenin como consejera técnica y desde 2001 es Directora Técnica llevando todos los temas regulatorios de la federación y su aplicación.

¿De qué hablamos en la jornada?
Para visualizar de una forma más esquemática cuáles pueden ser los pasos generales para obtener el ansiado marcado CE, a lo largo de toda la dinámica nos apoyamos en la siguiente infografía:
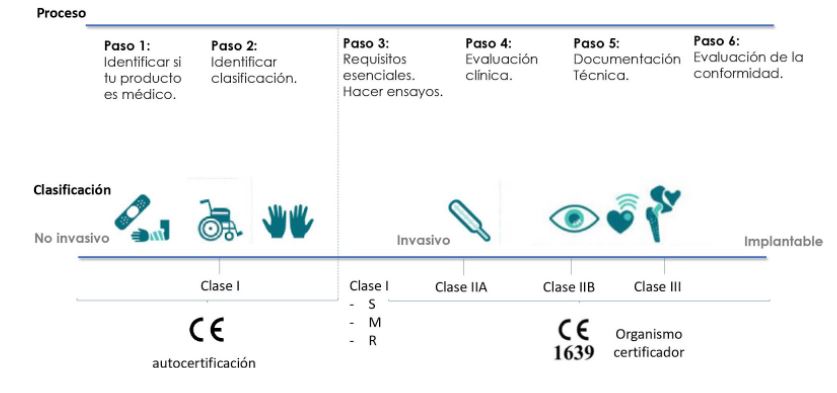
Paso 1
El proceso comienza identificando si realmente ese producto es de uso médico o no. Parece una pregunta aparentemente fácil de responder, pero hay veces que tiene ciertas complejidades. Por ejemplo, los softwares o aparatología estética donde debemos prestar atención a su finalidad.
Lo importante es atenerse a la definición de producto sanitario que ahora se ha matizado con el nuevo reglamento y se tiene que ajustar a una finalidad médica (la definición incluye conceptos como diagnóstico, investigación, desinfección y esterilización…) y el mecanismo de acción (que lo diferencia de los medicamentos).
María Aláez
El nuevo reglamento también incluye otro tipo de productos, como los de finalidad estética (productos de liposucción, depilación, lentillas estéticas, implantes estéticos…), que también se les debe aplicar el marcado CE. Es decir, algunos productos estéticos aunque no se les considera “medical device” sí que deberán entrar en la regulación del marcado CE.
En el caso de los software la “frontera” es compleja. Todos aquellos softwares que sirven para obtener información que ayude al personal sanitario a tomar decisiones requieren de un marcado CE, pero lo más recomendable en estos casos es analizarlos uno por uno.

Paso 2
En el siguiente paso se debe identificar la clasificación. En función de la clase de producto se podrá realizar una autocertificación (cuando se trata de un producto sanitario muy sencillos, no invasivos…) o una certificación a través de un organismo notificado (productos médicos más complejos, invasivos, implantables…).
Para ello, también se deberá acudir al reglamento donde se detallan 22 reglas que ayudan a la clasificación correcta del producto. Además, debemos tener en cuenta, por ejemplo, si un producto se ajusta varias reglas siempre nos tenemos que ir a la clasificación más alta.
La clasificación depende principalmente de la invasibilidad del producto, el tiempo de uso del mismo, el punto de contacto, si es activo, si tiene medicamentos, el tipo de tejido…
Y…¿Hay un periodo de tiempo estándar para la obtención del Marcado CE? Los tiempos de certificación del marcado CE son muy variables y dependen del producto y de la empresa.
A nivel general, en el mejor de los casos, podríamos obtener el marcado CE en un periodo de 6 meses. Pero es muy atrevido hacer este tipo de estimación ya que depende de cada producto sanitario y del “cariño” que se dedique a la preparación de la documentación necesaria. Lo más recomendable es apoyarse en instituciones con mucha experiencia para que este proceso sea lo más ágil posible.
Paso 3
En este paso se deberán revisar aquellos requisitos esenciales que deberá tener el producto y por lo tanto, implantarlos en el mismo. Sin un cumplimiento estricto de los requisitos técnicos necesarios no se podrá obtener el marcado CE.
Además, se tendrá que probar el producto para obtener información y datos científicos que soporten su finalidad, beneficios, evaluación de efectos secundarios…

Paso 4
Se trata de una parte esencial, que pasa por verificar todos los datos obtenidos a través de evaluaciones clínicas. Los procedimientos de prueba son útiles para determinar los riesgos que pueden surgir durante el uso de los productos.
Paso 5
El quinto paso es la preparación del archivo técnico. Este archivo debe contener toda la documentación técnica que incluya los resultados de las pruebas y los informes que demuestren que el producto cumple con los requisitos técnicos pertinentes.
Paso 6
Finalmente, deberá prepararse una declaración de conformidad que será evaluada por el organismo certificador si se requiere. Esta debe ser preparada por el fabricante y debe indicar que el producto cumple con todos los requisitos legales pertinentes.
En este proceso, un organismo notificado puede identificar la no conformidad del producto y se daría un plazo para subsanar los errores aunque las ponentes nos comentan que la mayoría de empresas no tienen problema en la conformidad final, puesto que previamente han pasado un proceso muy estricto donde se han ido solucionando los posibles inconvenientes.
Una vez se ha obtenido la certificación del marcado CE, la validez del mismo es de 5 años si se cumplen tres condiciones para aquellos productos que han sido certificados por un organismo: auditoría anual planificada, comunicar al organismo cualquier cambio relevante en la organización que pueda afectar al marcado CE y finalmente una auditoría no anunciada. Según la complejidad de algunos productos la validez puede ser menor.
¿Y cómo está siendo el cambio hacia la nueva normativa?
Ahora, con el cambio de la directiva anterior al nuevo reglamento hay ciertas “reglas” que se han endurecido.
Con la nueva normativa, los organismos notificados se han visto reducidos por lo que los procesos de certificación se han endurecido… Si ya eran largos, ahora se están demorando aún más y la entrada de nuevas empresas que necesitan el marcado está costando más que nunca.
Desde SGS, como organismo certificador, se está viviendo este cambio como “el surfista que ve ante él una ola de 7 metros”: es un reto pero están preparados. Están teniendo mucha más carga de trabajo y por eso están duplicando recursos para cubrir la demanda.
También, a raíz del aplazamiento que se concedió por la pandemia ha ayudado a las empresas a prepararse aún más para la obtención de la certificación y se ha concedido un “periodo de gracia” hasta 2024 para que las empresas que estaban bajo la anterior directiva puedan realizar el cambio a la nueva regulación. Por lo que María nos comentó que si las empresas no se planifican y van realizando el cambio nos encontraremos en 2024 con un cuello de botella donde todas las empresas querrán realizarlo.
Como conclusión final nos recomiendan que durante este proceso de certificación la empresa debe ser muy sistemática (tiene que haber un procedimiento planificado y todo tiene que estar documentado y justificado) y aplicar todos los requisitos detallados, siendo de especial importancia apoyarse en instituciones y profesionales así como en los propios organismos certificados que acompañen durante el proceso
Y tu empresa, ¿necesita de la certificación del marcado CE?
Si es así y necesitas ayuda adicional ¡no te cortes y pregúntanos!, quizá podemos ponerte en contacto con SGS o Fenin y resolver cualquier duda adicional que puedas tener. Nos vemos 🙂
¿Quieres impulsar tu proyecto?


![¿Cómo hacer la nota de prensa perfecta? [+EJEMPLOS]](https://lanzadera.es/wp-content/uploads/2019/01/11-tips-para-hacer-la-nota-de-prensa-perfecta.-1-768x513.jpg)
![Cómo hacer un plan de negocios en 8 pasos [+GUÍA descargable]](https://lanzadera.es/wp-content/uploads/2019/09/Como-hacer-un-plan-de-negocios-guia-768x512.jpg)








